一、肿瘤干细胞
肿瘤干细胞(cancer stem cell, CSC)是一类具有自我更新、高致瘤性, 分化潜能、高度耐药等特征的恶性肿瘤细胞群. CSC不仅保留了正常干细胞的性质, 并且独具自身特点, 研究CSC为肿瘤的靶向治疗开辟新途径。
1、实体瘤中肿瘤干细胞模型
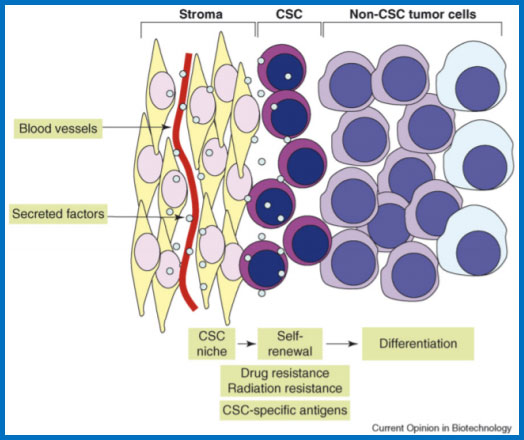
CSC与肿瘤的基质成分相关,包括成纤维细胞和血管,它们构成CSC“生态位”。 生态位细胞分泌辅助CSC自我更新的细胞因子。 CSC保留了分化潜能,从而产生肿瘤组织中大部分的非自我更新肿瘤细胞,CSC可以具有抗药性和抗辐射能力,可以表达CSC特异性抗原。
实体瘤中肿瘤干细胞模型
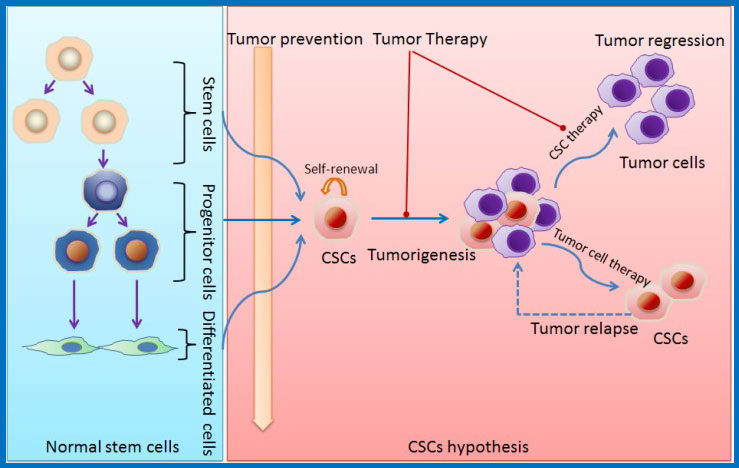
2、正常干细胞和肿瘤干细胞(CSC)示意图
左图:正常干细胞增殖和分化。 右图:CSC和肿瘤发生以及CSC对癌症治疗的影响
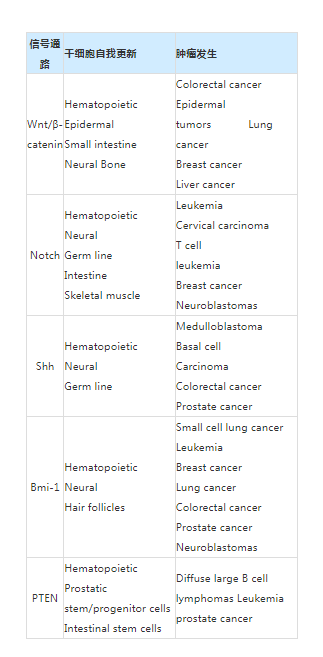
3、干细胞信号转导与肿瘤发生的关系
4、肿瘤干细胞Workflow
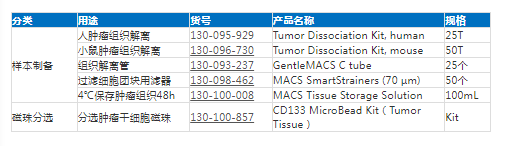
相关产品推荐:
肿瘤干细胞在实体瘤中Marker表达情况如下:
二、造血干细胞
造血干细胞(Hematopoietic stem cells, HSCs):可见于骨髓、外周血及脐带血,是血液系统中的成体干细胞,是一个异质性的群体,具有长期自我更新的能力和分化成各类成熟血细胞的潜能,对于血液疾病和血液相关肿瘤的研究非常重要。
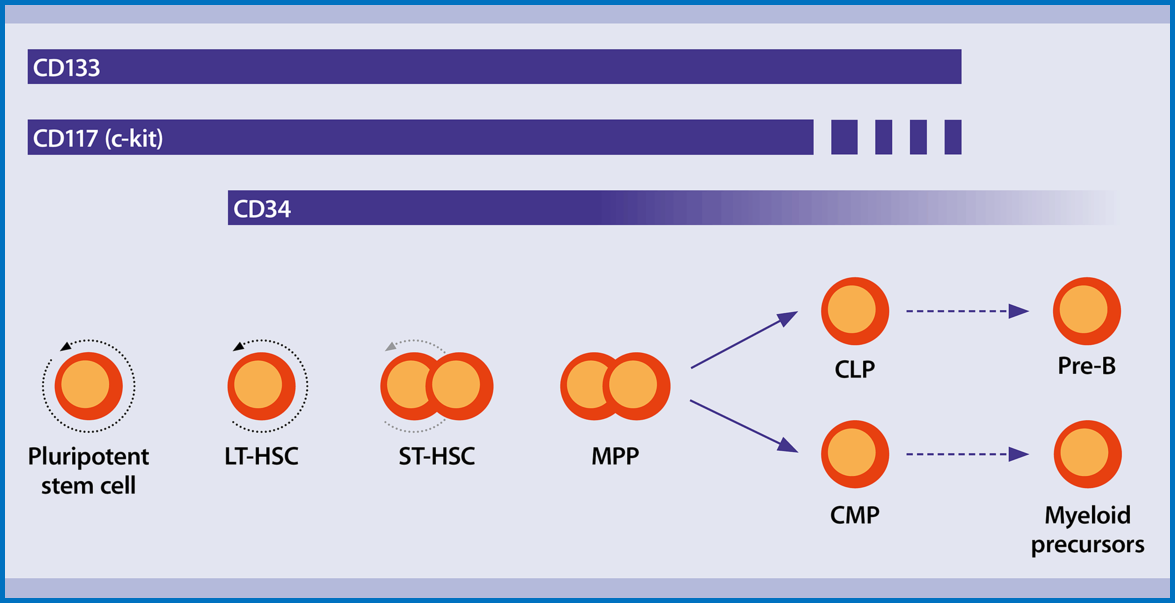
1、造血干细胞的发育
HSC可以细分为长期自我更新的HSC,短期自我更新的HSC和多能祖细胞(红色箭头表示自我更新)。它们产生共同的淋巴祖细胞(CLPs;所有淋巴细胞的前体)和常见的骨髓祖细胞(CMPs;所有骨髓细胞的前体)。
造血干细胞分化发育图
2、造血干细胞分化发育过程中的信号通路
Wnt、Shh和Notch途径已被证明有助于各种器官中干细胞和/或祖细胞的自我更新,包括造血和神经系统。当失调时,这些途径可以促成肿瘤发生,包括结肠癌和表皮肿瘤(Wnt),成神经管细胞瘤和基底细胞癌(Shh),以及T细胞白血病(Notch)。
造血干细胞分化发育过程中信号通路
3、造血干细胞占比及表面Marker
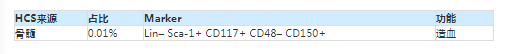
(1)小鼠样本
(2)人样本
CD34 是一种常用于鉴定人 HSC 的标记物
人造血干细胞表面Marker表达
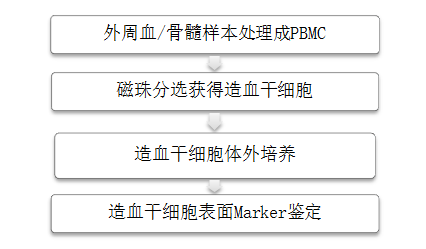
4、造血干细胞Workflow
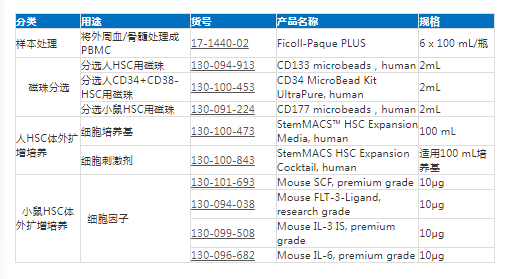
相关产品推荐:
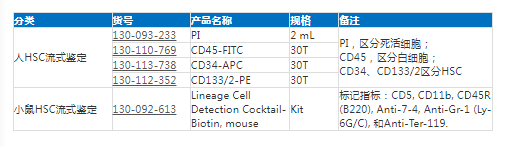
造血干细胞表面Marker鉴定
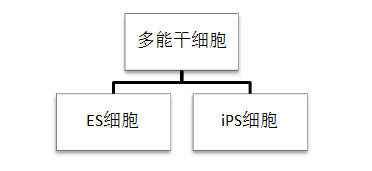
三、ES/iPS细胞
ES细胞也称胚胎干细胞(embryonic stem cell,ES):胚胎干细胞是早期胚胎(原肠胚期之前)或原始性腺中分离出来的一类细胞,具有体外培养无限增殖、自我更新和多向分化的特性,ES细胞经遗传操作后仍能稳定地在体外增殖传代。胚胎干细胞在治疗心血管疾病、帕金森氏症、老年性痴呆症、脊髓损伤、白血病、糖尿病等顽症的治疗方面, 具有广阔的前景。
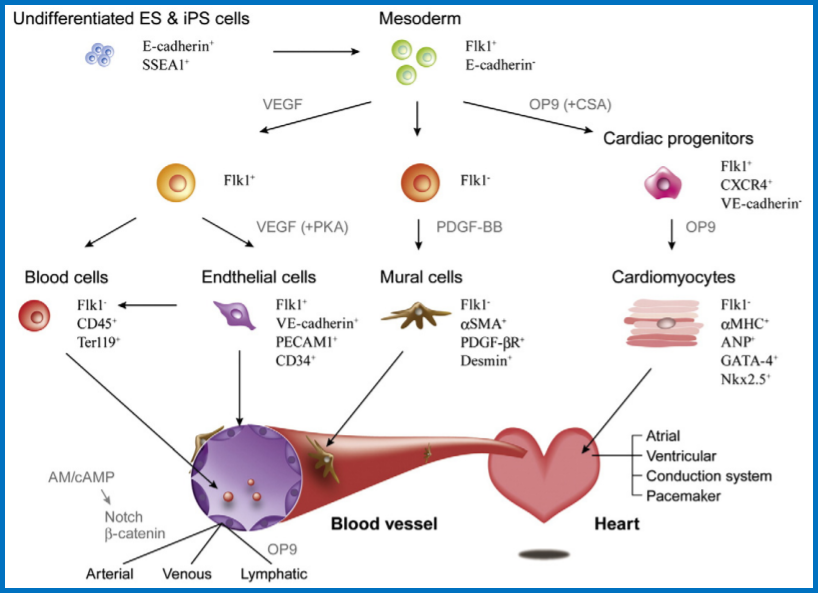
1、ES和iPS用于心血管再生
iPS细胞也称诱导多能干细胞(induced pluripotent stem cells ,iPS):2006年日本京都大学Shinya Yamanaka在世界著名学术杂志《细胞》上率先报道了诱导多能干细胞的研究。他们把Oct3/4,Sox2、c-Myc和Klf4这四种转录因子基因克隆入病毒载体,然后引入小鼠成纤维细胞,发现可诱导其发生转化,产生的iPS细胞在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸形瘤生成能力、分化能力等方面都与胚胎干细胞相似。
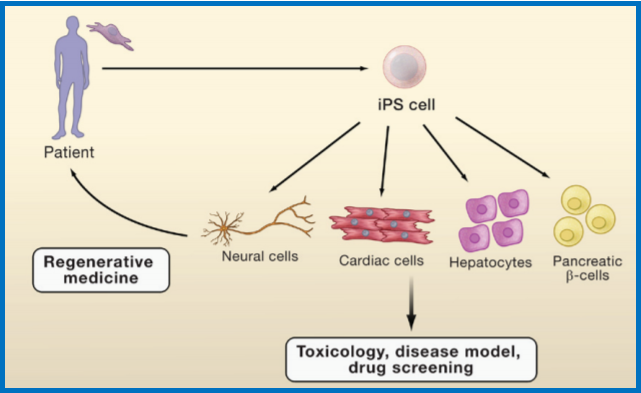
通过筛选患者的iPS细胞可以产生与之遗传信息相同的各种细胞,这些细胞可以用于构建疾病模型,筛选安全有效的药物以及细胞移植疗法治疗。
iPS细胞技术应用
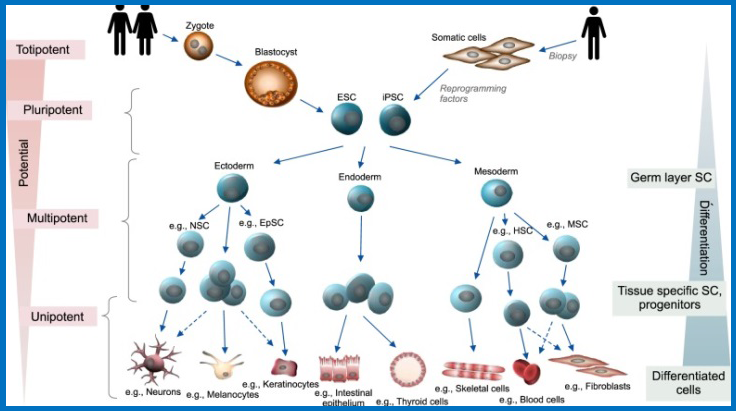
2、多能干细胞分化的经典层次
多能干细胞的两个关键特征:自我更新——维持未分化状态的细胞分裂,以及通过分化成特定细胞类型的体内和体外重建特定组织的能力。(备注:ESC:胚胎干细胞,iPSC:诱导的多能干细胞,NSC:神经干细胞,EpSC:表皮干细胞,HSC:造血干细胞,MSC:间充质干细胞。)
干细胞分化的经典层次模型
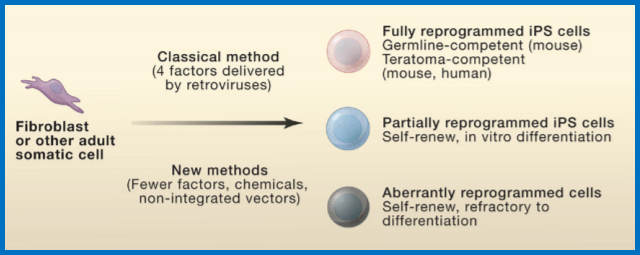
获取iPS的新旧方法对比
完全重编程的iPS细胞与ES细胞相当,部分重编程的iPS细胞可自我更新并分化成某些细胞谱系,异常重编程的细胞可以自我更新但难以分化。
获得iPS的三种方法
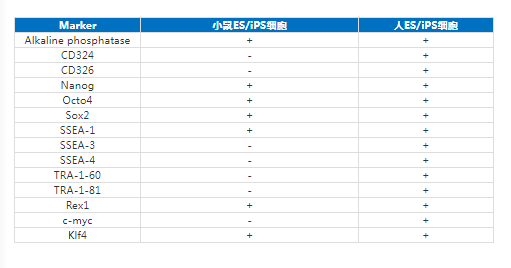
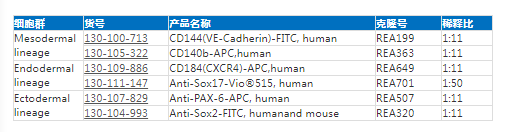
人和小鼠ES/iPS表面Marker表达
ES/iPS细胞研究Workflow
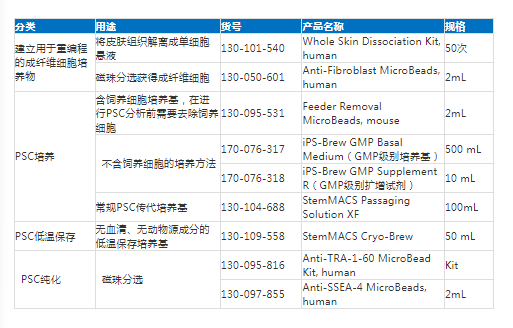
相关产品推荐:
PSC分化潜能分析配色方案:
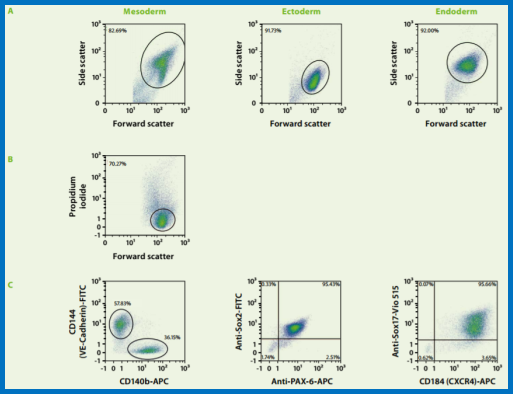
PSC分化潜能圈门策略
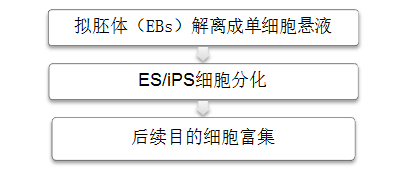
ES/iPS细胞分化Workflow
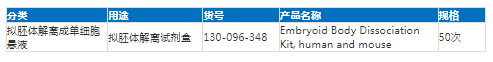
相关产品推荐:
ES/iPS细胞分化及后续目的细胞富集
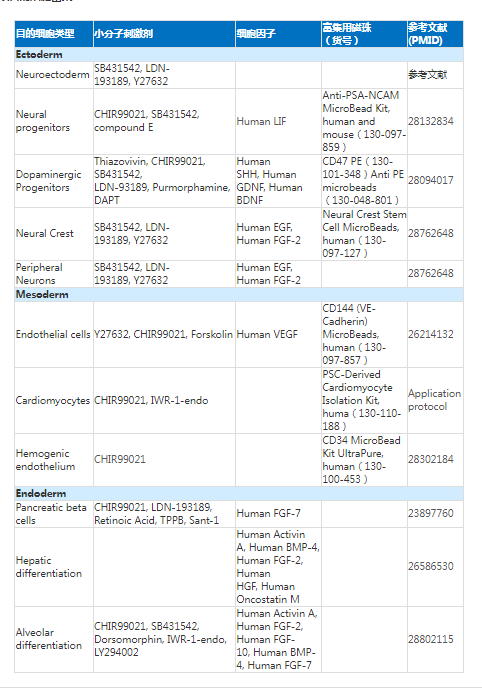
四、间充质干细胞
间充质干细胞(MSC, mesenchymal stem cells):是一类存在于多种组织(如骨髓、脐带血和脐带组织、胎盘组织、脂肪组织等),具有多向分化潜力,非造血干细胞的成体干细胞。这类干细胞具有向多种间充质系列细胞(如成骨、成软骨及成脂肪细胞等)或非间充质系列细胞分化的潜能,并具有独特的细胞因子分泌功能,细胞模型被应用于增殖、移植和分化研究,以及体外的免疫反应的鉴定。
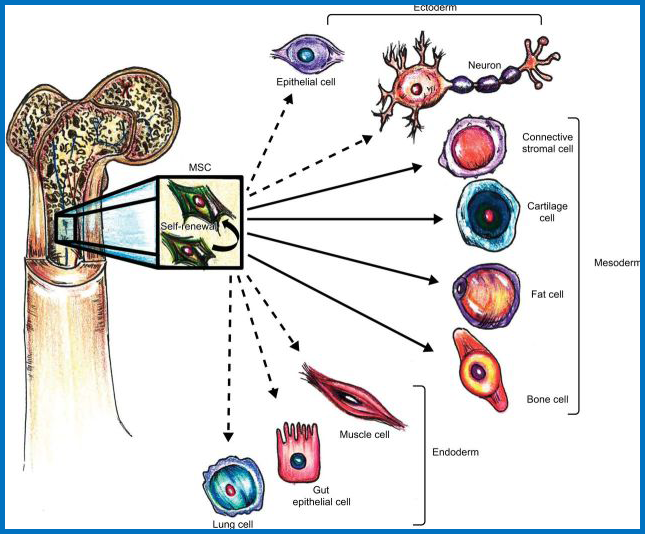
MSC的多向分化潜能
MSC具有在骨髓内自我更新的能力(弯曲箭头)。它们还可以分化成中胚层谱系的细胞类型(实线箭头)以及外胚层和内胚层谱系(虚线箭头)。
间充质干细胞的多向分化潜能
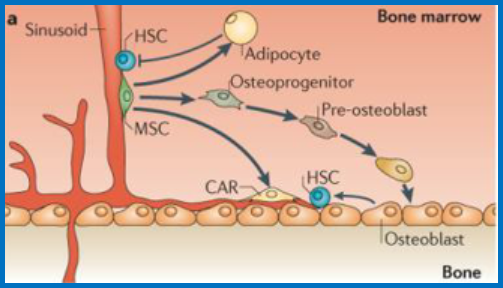
1、骨髓中MSC的生物学功能
骨髓间质干细胞(MSC)被认为是骨髓基质细胞(脂肪细胞、软骨细胞、成骨细胞)的共同前体细胞。在体外易于传代扩增,且具有多向分化潜能。
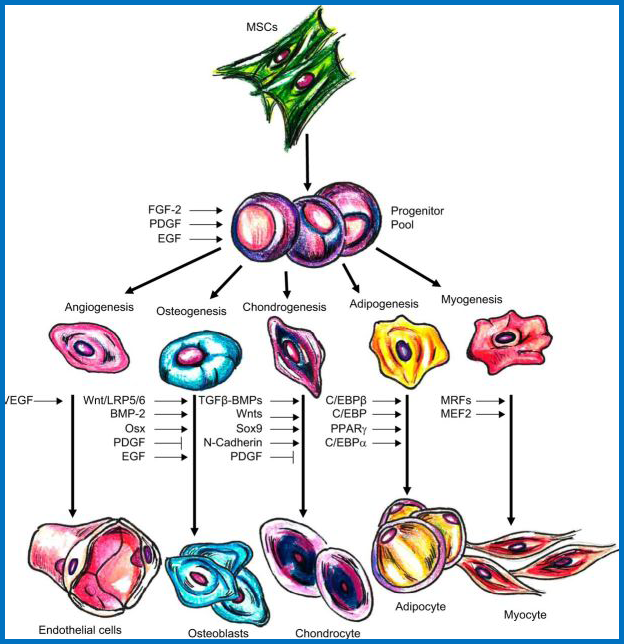
2、参与MSC分化调节的转录因子和信号分子
不同的细胞因子参与MSC的诱导分化,诱导后的MSC细胞可以定向分化成不同的细胞类型。(备注:BMP-2,骨形态发生蛋白-2; EGF,表皮生长因子; FGF-2,成纤维细胞生长因子-2; LRP5 / 6,低密度脂蛋白受体相关蛋白-5/6; MEF2,肌细胞增强因子-2; MRF,肌源性调节因子; Osx,Osterix; PDGF,血小板衍生生长因子; RUNX2,与runt相关的转录因子-2; TGF-β,转化生长因子-β; VEGF,血管内皮生长因子)。
参与MSC分化调节的转录因子和信号分子
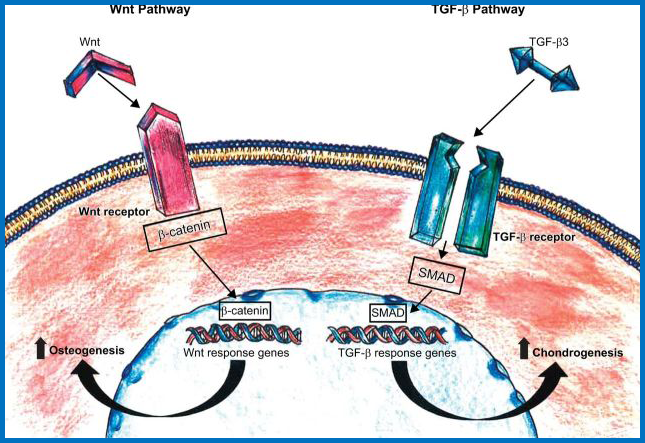
3、参与MSC分化的主要信号通路
Wnt和TGF-β信号传导途径负责调节MSC向成骨细胞和软骨细胞的分化,同时通过激活细胞内级联反应以及随后基因表达的修饰来促进其增殖和存活。
MSC分化信号通路图
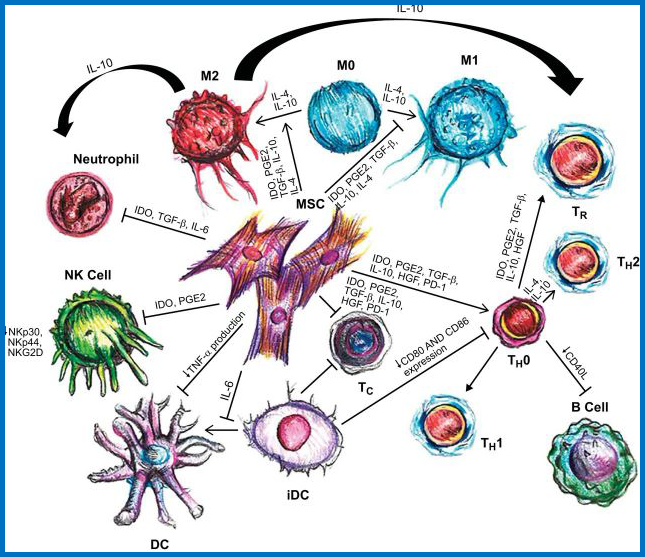
4、MSC与免疫系统之间相互作用
MSCs可通过多种途径抑制T辅助细胞(TH)和细胞毒性T细胞(Tc)的增殖, MSC向TH2和调节性T细胞(Treg)的分化,导致抗炎环境;
IL-6通过抑制CD40,CD80和CD86的上调来阻断树突细胞(DC)的成熟,其随后减少T细胞活化。
MSC刺激单核细胞以优先向M2表型分化。由M2巨噬细胞产生的IL-10可以促进Treg的形成,同时减少中性粒细胞组织的迁移。中性粒细胞(多形核粒细胞; PMN)具有更长的寿命; 然而,活性氧(ROS)的产生减少,自然杀伤(NK)细胞增殖和细胞毒活性均受到抑制, B细胞增殖受到抑制,抗体的产生减少。(备注:HGF,肝细胞生长因子; IDO,吲哚胺 - 吡咯-2-3-双加氧酶; PGE2,前列腺素E2; 和TGF-β,转化生长因子-β。)
MSC与免疫系统之间相互作用
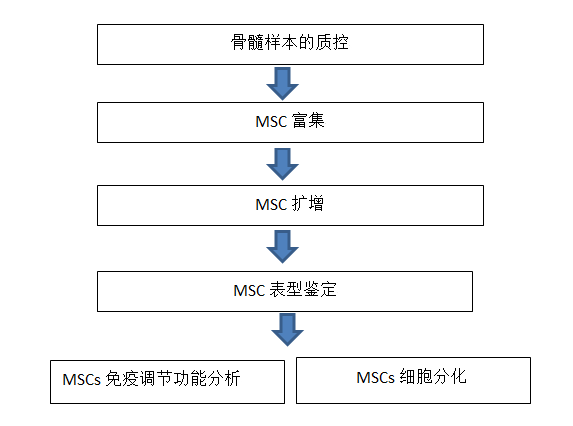
5、MSC研究Workflow
相关产品推荐: